

國(guó)家食品藥品監(jiān)督管理總局圍繞《醫(yī)療器械監(jiān)督管理?xiàng)l例》,,制修訂了《醫(yī)療器械注冊(cè)管理辦法》、《體外診斷試劑注冊(cè)管理辦法》,、《醫(yī)療器械說(shuō)明書(shū)和標(biāo)簽管理規(guī)定》,、《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》、《醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理辦法》等五部規(guī)章,,將于2014年10月1日施行,。
五箭齊發(fā),醫(yī)療器械全程系統(tǒng)性監(jiān)管體系形成,,五部規(guī)章核心要點(diǎn)是什么,?新舊版之間有何差異?《新康界》為您逐一解讀,。
· 表1 《醫(yī)療器械注冊(cè)管理辦法》解讀
|
關(guān)鍵點(diǎn) |
新版 |
舊版 |
|
I類(lèi)產(chǎn)品 |
備案制 |
注冊(cè)制 |
|
注冊(cè)備案對(duì)象 |
企業(yè)或個(gè)人 |
只能是企業(yè) |
|
鼓勵(lì)創(chuàng)新 |
特別審批渠道 |
無(wú)綠色通道 |
|
臨床試驗(yàn)資料 |
提供臨床評(píng)價(jià)資料 |
提供臨床試驗(yàn)資料 |
|
臨床試驗(yàn)審批時(shí)限 |
63個(gè)工作日完成 |
無(wú)此要求 |
|
注冊(cè)總周期 |
128個(gè)工作日(三類(lèi):221個(gè)工作日) |
|
|
特殊器械審批 |
治療罕見(jiàn)疾病以及應(yīng)對(duì)突發(fā)公共衛(wèi)生事件急需的醫(yī)療器械:先審批后完善注冊(cè) |
無(wú)此規(guī)定 |
|
無(wú)分類(lèi)產(chǎn)品的注冊(cè) |
可以先按三類(lèi)申請(qǐng) |
必須先申請(qǐng)分類(lèi)界定,死板 |
|
注冊(cè)組件之銷(xiāo)售 |
在滿足“更換耗材,、售后服務(wù),、維修等為目的”的條件下,組件可以單獨(dú)銷(xiāo)售 |
· 表2 《體外診斷試劑注冊(cè)管理辦法》解讀
|
關(guān)鍵點(diǎn) |
新版 |
舊版 |
|
注冊(cè)證有效期 |
5年 |
4年 |
|
樣品委托生產(chǎn) |
創(chuàng)新型可委托相應(yīng)范圍生產(chǎn)企業(yè)生產(chǎn)樣品,;非創(chuàng)新型不得委托生產(chǎn) |
|
|
研究型試劑 |
取消了“僅供研究,,不用于臨床診斷” |
用于研究可不注冊(cè) |
|
質(zhì)量標(biāo)準(zhǔn) |
產(chǎn)品技術(shù)要求 |
產(chǎn)品注冊(cè)要求 |
|
注冊(cè)與臨床試驗(yàn)的時(shí)間點(diǎn) |
第二、三類(lèi)產(chǎn)品只有注冊(cè)檢驗(yàn)合格后方可進(jìn)行臨床試驗(yàn)或者申請(qǐng)注冊(cè) |
產(chǎn)品研發(fā)成功就開(kāi)始準(zhǔn)備臨床試驗(yàn)工作 |
|
臨床試驗(yàn) |
取得資質(zhì)的臨床試驗(yàn)機(jī)構(gòu),,同時(shí)需要先備案 |
省級(jí)衛(wèi)生醫(yī)療機(jī)構(gòu)不需備案 |
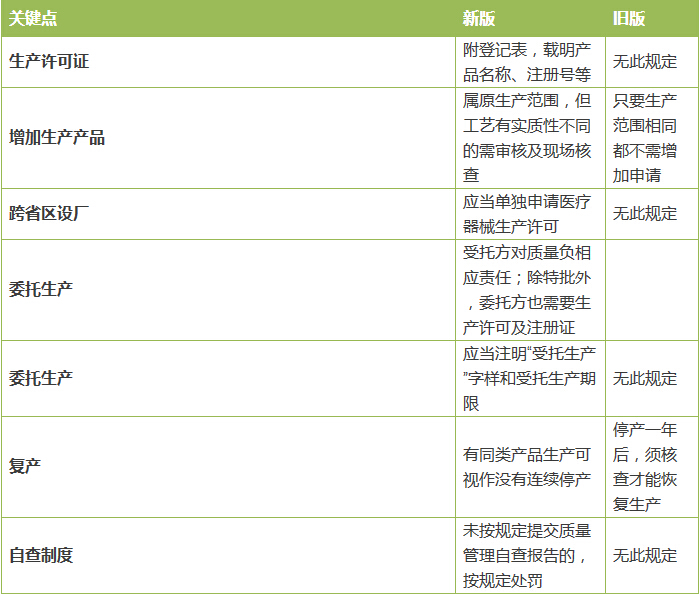
· · 表3 《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》解讀
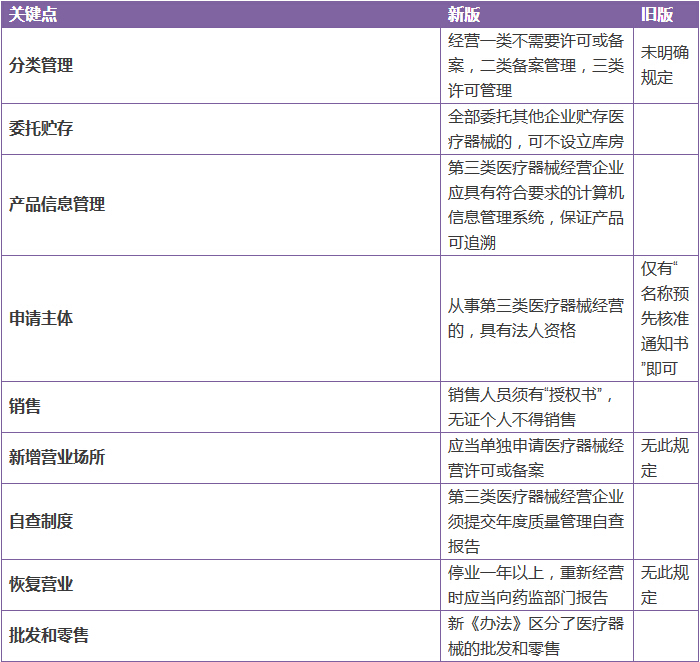
· 表4 《醫(yī)療器械經(jīng)營(yíng)監(jiān)督管理辦法》解讀
《醫(yī)療器械說(shuō)明書(shū)和標(biāo)簽管理規(guī)定》解讀
新規(guī)定由10號(hào)令的23條,,變更為6號(hào)令19條,但要求并沒(méi)有減少,,而罰則更清晰,,刪除一些重復(fù)的內(nèi)容,描述更準(zhǔn)確,。主要變化包括:
1.新的規(guī)章參考國(guó)際慣例,,將“包裝標(biāo)識(shí)”與“標(biāo)簽”合并為“標(biāo)簽”,避免了術(shù)語(yǔ)之間的交叉混淆,。對(duì)于重復(fù)使用的醫(yī)療器械,,新規(guī)章明確了管理要求。
2.對(duì)消費(fèi)者個(gè)人增加了要求,,明確由消費(fèi)者個(gè)人自行使用的醫(yī)療器械還應(yīng)當(dāng)具有安全使用的特別說(shuō)明,。
3.對(duì)于說(shuō)明書(shū)和標(biāo)簽所用名詞術(shù)語(yǔ)和顏色符號(hào)等,,新規(guī)章也予以了規(guī)范。
4.第一類(lèi)醫(yī)療器械實(shí)施備案管理已備案的醫(yī)療器械,,備案信息表中登載內(nèi)容,、備案產(chǎn)品技術(shù)要求以及說(shuō)明書(shū)其他內(nèi)容發(fā)生變化的,備案人可自行修改說(shuō)明書(shū)和標(biāo)簽的相關(guān)內(nèi)容,。